
关于美柏
美柏医健(MyBioGate) 致力于链接中国与海外医健创新。美柏医健分享全球医健创新项目及前沿知识,提供中国资源与海外创新项目的高效对接服务,帮助中国投资者洞悉全球最新发展态势,帮助海外创新企业找到值得信赖的中国投资者和合作伙伴。
联系我们:info@mybiogate.com

微信扫一扫
关注公众号


2019-04-12
导读:
1、 挑战一:如何攻破最致命的肿瘤:多形性成胶质细胞瘤(Glioblastoma, GBM)
2、 挑战二:如何开发真正的新一代靶向疗法?
3、 挑战三:CAR-T如何实现平民化?
在谈“癌”色变的年代,毋庸置疑,肿瘤成为全民最为关注的医疗领域。从传统的化疗,到靶向疗法,再到这几年炙手可热的肿瘤免疫疗法,攻破肿瘤的探索从未停止。根据IQVIA2018年发布的“全球肿瘤学趋势”报告显示,2013年到2017年,肿瘤新药物获批数量高达63种。
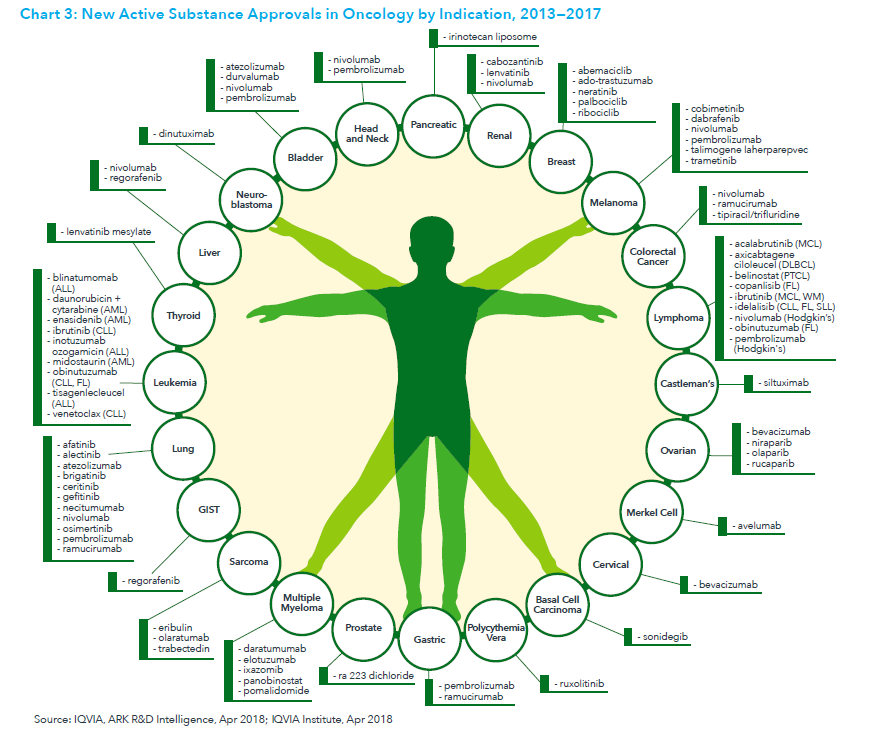
报告同时也指出,火热的肿瘤免疫疗法,现有的药物作用机理高达60种,这开启了无数的可能性,也同时验证了肿瘤作为极其复杂的疾病,在进行药物开发时需要严谨的科学理论支持以及突破式创新思维,才能从千丝万缕的的错综关系中寻找到根本。
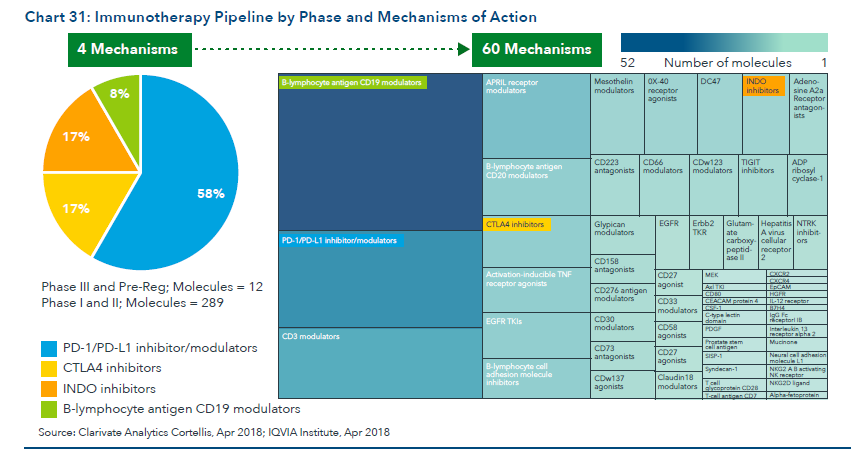
本文将抛砖引玉,从癌症治疗的几大核心挑战展开,并一一介绍海外前沿技术对此作出的相应对策。
1、挑战一
如何攻破最致命的肿瘤:多形性成胶质细胞瘤(Glioblastoma, GBM)
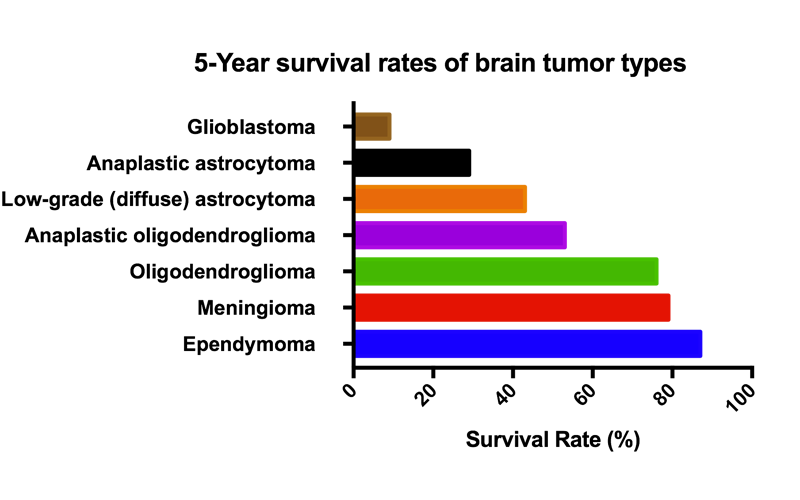
GBM是所有肿瘤最致命的类型之一,复发率几乎为100%, 5年总生存率只有约5%,而乳腺癌等控制较好的病人5年总生存率可达80%以上。现有GBM的标准治疗手段非常有限,主要是手术,放射治疗或联合放射治疗和化疗。迄今为止,获批的药物只有替莫唑胺、阿瓦斯汀、洛莫司汀、Carmustine晶片。遗憾的是,这些药物中位生存优势并不明显,也未观查到显著的患者存活延长。
2011年,由Novocure开发的Optune顺利获得FDA批准,用于治疗GBM。和传统的治疗方法不一样,Optune属于电场疗法,其机理是通过电场影响细胞分裂,从而导致快速分裂细胞(如癌细胞)的死亡。
在近700名完成放化疗的脑胶质瘤患者的临床试验中,Optune+替莫唑胺联合治疗,相比替莫唑胺,其中位总生存期从15.6个月,提高到了20.5个月。

▲Optune 产品图
在中国,《脑胶质瘤诊疗规范(2018版)》明确申明:“目前研究显示电场治疗安全且有效,推荐用于新发GBM(1级证据)和复发高级别脑胶质瘤的治疗(2级证据)。” 再鼎医药也已经获得了Optune的大中国区权益。
Optune给患者带来了希望,也给Novocure也带来了$280M的年销售额,但这个仪器有将近三斤重,病人每天携带非常不方便。为克服这一短板,项目T244做出了相应的改进。
T244项目
◇ 重量为85克
◇ 3个月以上的复发性GBM生存改善 (n=57)
◇ Optune在复发性GBM病人的中位无进展生存期为7个星期,T244为17个星期
◇ 预计2019年得到欧盟CE认证
◇ 在儿童脑瘤的应用有望获得FDA人道用途器材的免除(Humanitarian Device Exemption)
虽然电场疗法有它不可取代的优势,但非电场疗法依旧在研管线中占据着主导地位,包括分子靶向疗法,基因疗法,免疫疗法等 (如下图所示)。
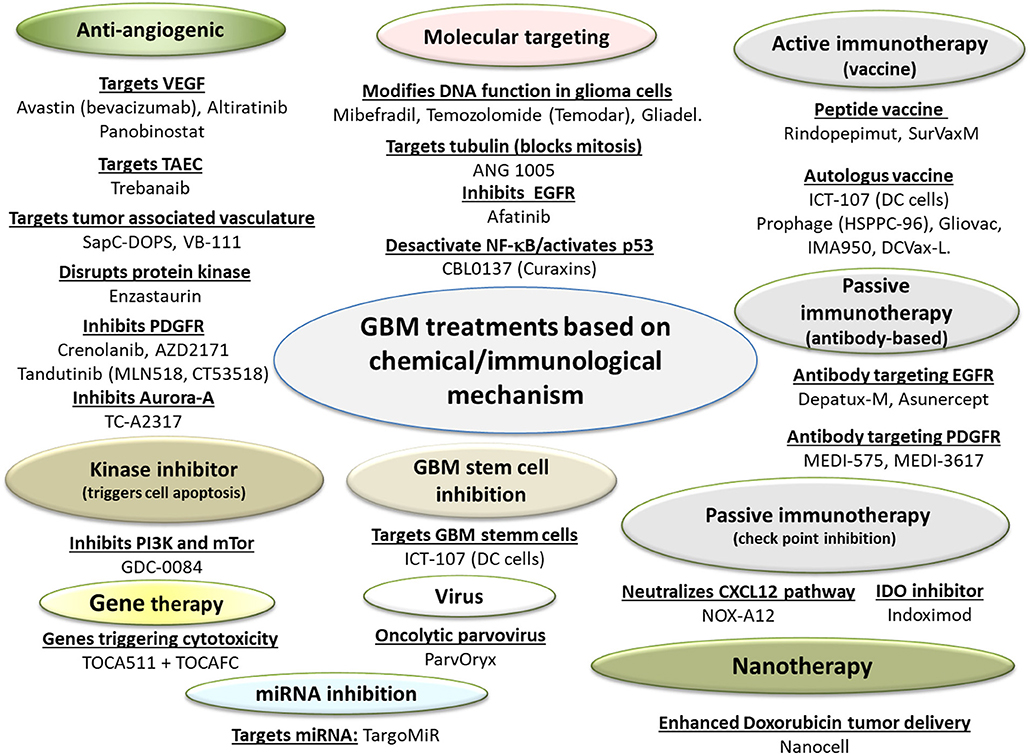
▲参考: Front. Pharmacol., 13 September 2018
治疗GBM,首先要解决两个重要的问题,第一是药物能穿透BBB(血脑屏障),第二是有肿瘤特异性。前者的话可以通过MRI辅助导管(Catheter)进行精准药物传递, 后者的话就必须有足够多的临床数据表明选择的靶点在GBM细胞中高表达,而在其他脑细胞(神经细胞,免疫细胞,星细胞等)不表达或者表达量很低。
从上图可以看到,大部分药物都是针对常见靶点,比如VEGFR、EGFR、PI3K等。其中就包括了和康哲药业建立了战略合作的VAXIMM,正在开发一种针对GBM的口服式减毒细菌疫苗,经过修饰可表达VEGFR2。
伴随着PD-(L)1联合疗法的热潮,治疗GBM也开始了此类的探索。值得指出的是,PD-(L)1抑制剂在GBM中的尝试并不乐观,最具代表性的临床试验CheckMate 143早期数据显示nivolumab未能延长复发性GBM患者的总生存期,而导致试验提早终止。
除了这些耳熟能详的,业内更期待的是创新型靶点能带给病人新的希望?在这里,推荐的是一个临床II期的产品:
T183项目
◇ 预计市场为20亿美元
◇ FDA+EMA双双获得孤儿药认定/快速通道
◇ 靶向受体在高于83%的成人GBM病人和高于76% 儿童GBM中表达
◇ 和替莫唑胺比较,总体生存率可从5.6延长到11.8个月。
◇ 实时影像观察来监控药物的传递
2、挑战二
如何开发真正的新一代靶向疗法?
近几年肿瘤领域的靶向疗法,若要说起最夺人眼球的,竞争最为激烈的,不得不提到CDK4/6以及PARP抑制剂。就CDK4/6来说,形成了三家鼎立的局势,当然Ibrance作为第一个获批的,其先发优势仍然非常明显。
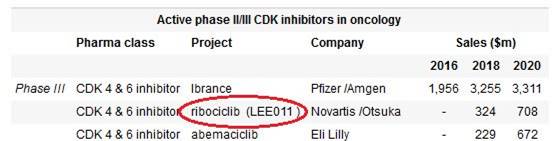
PARP的竞争局面就更为复杂。迄今为止,获批的产品有4个,全球处于活跃状态的PARP抑制剂高达40多个。 作为PARP抑制剂的同类第一产品,AstraZeneca的Olaparib在2014年批准用于卵巢癌的治疗后,临床试验在乳腺癌、胰腺癌、胃癌等领域广泛开展。
从国内情况来看,上市的PARP抑制剂只有Olaparib,用于铂敏感复发性卵巢癌的维持治疗。除Olaparib之外,再鼎从Tesaro手中拿到的Niraparib以及百济神州的Pamiparib进展最快,目前均处于III期。
在PARP抑制剂的巨大市场的吸引下,又有哪些能跳脱传统观念,有望脱颖而出的呢?有这么一款放射性标记的PARP抑制剂产品,除了治疗以外,还兼具检测等多功能:
T239项目
◇ 竞争者进入壁垒高
◇ 多功能:诊断、生物标志物、治疗、影响观察
◇ 暂无其他临床期的类似产品
◇ 已完成人体和动物的概念认证
3、挑战三
CAR-T如何实现平民化?
诺华旗下的CAR-T产品Kymriah 以及Gilead旗下的Yescarta获批后销售均不及预期。这种近五十万美元的高昂价格显然限制了其市场潜力,尽管医保方面正在做努力,也提出了Pay-for-performance的尝试,但若要从根本上解决问题,还是需要降低成本。
在这大背景下,“即用型(off the shelf) ”CAR-T的概念应运而生。
“即用型”CAR-T是将健康供体的T细胞,通过一系列基因改造和扩增,使其能通用于所有病人的新型细胞制备技术。和传统的CAR-T比较,这一技术大大简化了CAR -T细胞生产的周期和成本,也能达到大规模的工业化生产以及标准化的质量控制,保证了不同批次产品之间质量的稳定均一。
Cellectis是最早开始布局“即用型”CAR-T的公司之一,其临床试验UCART19公布的83%的完全缓解率与诺华的Kymriah用于报批FDA的数据完全一致。
那么除了Cellectis,还有哪些企业值得关注?先介绍一个针对亚洲流行癌症类型-肝癌的即用型CAR-T。
T158项目
◇ 全球200+专利保护
◇ 无需组织类型匹配,一个健康个体捐赠的细胞可供750个病人进行治疗
◇ 定价为$5,000,只有现有CAR-T疗法的1%
◇ 已完成的临床试验对象为亚洲人群
◇ 其临床数据显示了在晚期肝癌病人中的疗效优势(如下图)

除T细胞外,同样具有杀伤作用的还有两大类细胞,一是巨噬细胞,可以吞噬外来敌人后呈递给T细胞;二是自然杀伤细胞(NK细胞),可通过释放细胞因子杀伤细胞。随着生物技术的迅猛发展,各大企业集思广益,也慢慢开始了其他非T细胞疗法的探索。
其中最为独特的是一款基于CAR-NKT的即用型细胞疗法。NKT细胞是一群细胞表面既有T细胞受体TCR,又有NK细胞受体的特殊T细胞亚群,作为细胞疗法有着它独特的优势。
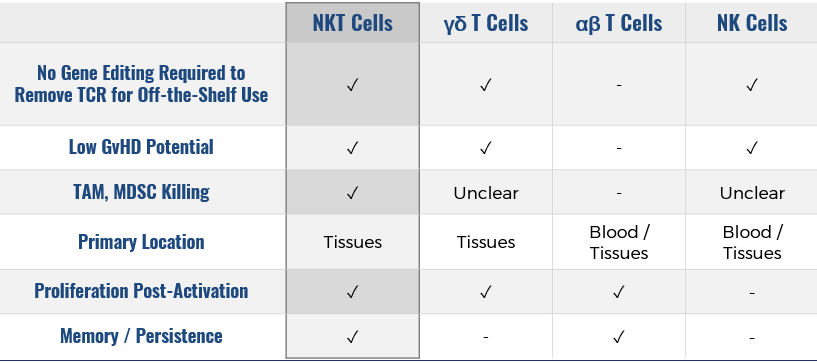
T252项目
◇ 早期临床试验无细胞因子风暴等毒性
◇ 能释放IL-15增强抗肿瘤反应及延长药效
◇ 可针对实体瘤
◇ 动物试验中显示可延迟肿瘤进展从3周到22周
以上5个创新项目寻求中国合作伙伴,想要了解更多信息,请咨询美柏医健中国区商务总监:
联系人:戴有文
电 话:+86-15151852853(同WeChat)
邮 箱:youwen.dai@mybiogate.com
想了解更多癌症治疗的挑战及全球创新的聚焦点,请继续关注《【深度解读】看海外前沿技术如何突破癌症治疗的关键瓶颈》系列文章。
+ 关注

hi,
提交评论




+ 关注
[Ta的贡献]
查看更多 >
投资人交流群
限量名额,微信扫码申请