
关于美柏
美柏医健(MyBioGate) 致力于链接中国与海外医健创新。美柏医健分享全球医健创新项目及前沿知识,提供中国资源与海外创新项目的高效对接服务,帮助中国投资者洞悉全球最新发展态势,帮助海外创新企业找到值得信赖的中国投资者和合作伙伴。
联系我们:info@mybiogate.com

微信扫一扫
关注公众号


2018-08-09
一部刚刚上映的电影戳了广大中国老百姓的心窝子,这就是《我不是药神》。“一颗价值十亿美金的药丸”,让人们再次认识到了天价原研药和仿制药的价格鸿沟,但也让无数的癌症患者看见了曙光。
片中提到的伊马替尼Imatinib(格列卫,Glivec),是针对慢性粒细胞白血病及胃肠道间质瘤的分子靶向药物。靶向治疗,顾名思义就是在细胞分子水平上针对明确的致癌位点设计的治疗药物,药物进入体内后特异性选择致癌位点或针对特定的病变部位,在目标部位蓄积或释放有效成分,而不会波及肿瘤周围的正常组织细胞,在提高药效的同时抑制毒副作用,并减少对正常组织、细胞的伤害。2016年5月,通过国家药品价格谈判试点,用于治疗肺癌的盐酸埃克替尼Icotinib(凯美纳,Conmana)、吉非替尼Gefitinib(易瑞沙, Iressa)和治疗慢性乙型肝炎的富马酸替托福韦二吡呋酯Tenofovir Disoproxil Fumarate(韦瑞德,Viread),均出现“腰斩式”降价。2017年7月,36种药品被纳入国家医保目录,其中一半是肿瘤治疗药物,影片中提到的格列卫也是其中之一。其实不止血液病,随着新药不断地研发,越来越多的靶向药物也逐渐问世。目前针对妇科肿瘤的分子靶向药物并不在少数,但是相比较治疗血液病和肺癌的靶向药物来说,似乎就没有那么“出名”了。
宫颈癌、卵巢癌和子宫内膜癌是妇科最常见的三种恶性肿瘤,现已经有4类分子靶向药物作为针对妇科肿瘤治疗的一线/二线用药,分别为主要包括抗血管生成药物、聚腺苷二磷酸核糖聚合酶[poly-(ADP-ribose)polymerase, PARP]抑制剂、免疫抑制剂及表皮生长因子(epithelial growth factor, EGF)受体阻断剂。
1 抗血管生成药物
血管生成是肿瘤发展和转移的重要过程,主要是通过血管内皮生长因子(vascular endothelial growth factor,VEGF)激活细胞表面酪氨酸激酶受体(VEGFR1,2,3),产生下游信号促使血管内皮细胞增殖、迁徙、血管通透性增加,最终形成新的血管。VEGF受体及其配体是肿瘤新血管生成和淋巴管生成的中心介质,VEGF表达上调和VEGF受体2(VEGFR2)表达上调是卵巢癌的独立预后不良因素。
(1)贝伐珠单抗(bevacizumab)
贝伐珠单抗(bevacizumab)是一种针对VEGF的人源化单克隆抗体,其目的是中和VEGF亚型并通过VEGFR1和VEGFR2直接阻断信号转导[1],是首个被美国食品和药物管理局(FDA)批准的通过抑制血管生成发挥抗癌作用的新药。安维汀(Avastin,贝伐珠单抗注射液)由罗氏(Roche)公司生产,于2004年在美国上市,用于治疗多种恶性肿瘤,包括转移性结直肠癌、转移性非小细胞肺癌、复发性多发性胶质母细胞瘤和肾细胞癌,主要通过使肿瘤血管退化、使存活血管正常化、持续抑制新生和再生血管生长三个途径对肿瘤进行控制和治疗。
2014年在西班牙马德里举行的欧洲肿瘤内科学会年会上,作为最新摘要接受了使用和不使用贝伐珠单抗治疗晚期宫颈癌的III期随机试验的最终总生存分析(GOG 240分析)[2]。?研究显示,与单独化疗相比,复发性或持续性宫颈癌患者贝伐珠单抗组的生存期显着改善(17个月Vs.13.3个月),无进展生存期也有显著改善(8.2个月Vs. 5.9个月)[3]。该研究的重要性在于它代表了目标药物首次达到治疗的主要终点,改善了妇科癌症患者的生存期。在妇科肿瘤学组(GOG)240公布后,FDA批准贝伐珠单抗可用于治疗转移性宫颈癌[1]。该药于2010年2月获得中国食品药品监督管理局批准,用于转移性结直肠癌的治疗后,于2010年10月在中国上市。然而,贝伐珠单抗中国版说明书中的适应症只有转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌,医保也限晚期转移性结直肠癌或晚期非鳞状非小细胞肺癌。这意味着用于妇科肿瘤时患者需要全部自费。
(2)卡博替尼(cabozantinib)
卡博替尼(XL184)是一种小分子激酶抑制剂,对MET和VEGFR2以及其他几种参与肿瘤病理生理过程的酪氨酸激酶受体都有潜在作用。基于卵巢癌具有高度血管生成的表型,以及卵巢癌细胞中直接MET失调的证据,一项由九种不同肿瘤类型组成的II期随机停药试验(NCT00940225)中,卵巢癌被选为评估卡博替尼疗效和安全性的肿瘤类型之一。结果显示实验组的PFS为5.9个月,而安慰剂组仅为1.4个月,且铂敏感患者的中位PFS为6.9个月,结论认为卡博替尼单药治疗复发性卵巢癌患者具有活性[4]。
在卵巢癌中正在探索多种靶向针对VEGF信号通路的药物,如:舒尼替尼(Sunitinib)、帕唑帕尼(Pazopanib)、拉帕替尼(Lapatinib)、西地布尼(Cadiranib)等。这些药物均有II期临床试验,用于单药或联合治疗复发性宫颈癌,并且在卵巢癌治疗中显示出较好的疗效。可惜的是,目前上述药物均未成为治疗卵巢癌、复发性或转移性宫颈癌的一/二线治疗方案。
2 聚二磷酸腺苷核糖聚合酶抑制剂(PARP-i)
FDA现已批准三种PARP-i作为乳腺癌和卵巢癌易感基因(BRCA)突变型高级别浆液性卵巢癌的治疗药物,这三种药物分别是olaparib胶囊(Lynparza™; 阿斯利康),niraparib(Zejula™; Tesaro Inc)和rucaparib(Rubraca™;Clovis Oncology)。欧洲药品管理局(EMA)已于2014年批准了olaparib用于维持治疗,2017年8月,FDA批准olaparib片剂作为铂类化疗后进行维持治疗的二线用药。这三种药均为聚二磷酸腺苷核糖聚合酶抑制剂(PARP-i)。
上皮性卵巢癌(epithelial ovarian carcinoma,EOC)是妇科恶性肿瘤死亡的主要原因,在女性常见恶性肿瘤中排第7位。根据中国癌症统计数据,2015年中国新增卵巢癌病例数约52100例,死亡病例数约22500例[5]。细胞减灭术结合铂类药物化疗是治疗EOC的一线方法,尽管效果很好,但总体而言5年生存率仅为28%[6]。妇科肿瘤学界现在认为上皮性卵巢癌是几种疾病的总称,因其具有非常明显的病因、分子亚组和临床行为。FDA批准聚二磷酸腺苷核糖聚合酶抑制剂(PARP-i)用于在乳腺癌和卵巢癌易感基因(BRCA)突变型的高级别浆液性卵巢癌(HGSOC)中,就是利用该亚群的成功范例。基于这项新概念数十年的研究,这三种药物的批准上市也具有了里程碑式的意义。

(1)Olaparib
Olaparib是晚期BRCA1/2突变卵巢癌患者中最广泛研究的PARP-i,最近被FDA加速批准用于复发和维持治疗晚期BRCA1/2突变卵巢癌的患者,并且也得到了欧洲药品管理局(EMA)监管部门批准。
已经有许多I/II期试验评估了olaparib在BRCA1/2突变卵巢癌患者中的临床效果,在BRCA突变型或BRCA野生型、铂类敏感或不敏感的卵巢癌患者中均能提高患者的客观应答率(ORR),总体而言,临床受益率约为46-52%,铂类敏感患者的ORR可达69%[7]。在I期临床试验中,olaparib胶囊最大耐受剂量为400 mg,2次/日,后期阿斯利康研发出olaparib片剂,300 mg,2次/日即可达到良好效果,且耐受性更好[8]。
已有消息称 olaparib治疗BRCA突变型晚期卵巢癌的III期随机临床试验SOLO-1(NCT01844986)取得了积极结果,Lynparza作为一线维持治疗的疗效显著,无进展生存期(progression-free survival,PFS)也得到了统计学意义上的显著改善,且安全性、耐受性于其他临床试验一致。同时,一项随机III期临床试验SOLO-3 正在进行中,该试验评估Olaparib单药治疗与医师选择单药化疗治疗携带种系BRCA1/2突变的患者的铂敏感性复发性卵巢癌的疗效和安全性(NCT02282020)。目前,olaparib在我国尚未有正式中文名称和商品名,俗称“奥拉帕尼”,于今年有望获得我国药监局的加速审批从而上市。
(2)Rucaparib
Rucaparib(旧称CO-338,AG-014699和PF-01367338; Clovis Oncology)是另一种口服的PARP-i。rucaparib单药治疗于2016年12月19日获得FDA的加速批准,用于治疗有害种系和/或体细胞BRCA突变型相关的晚期卵巢癌的患者。 rucaparib的推荐剂量是600mg(2*300mg,片剂),每天口服两次。该批准是基于对106名高级别浆液性卵巢癌和BRCA突变型铂类治疗患者(铂类敏感和耐药)参与的研究和ARIEL2的综合疗效分析,PFS为10.0个月,临床受益率约为45%,铂类敏感患者的ORR为66%,铂类耐药患者的ORR为25%[9]。另一项随机对照双盲临床试验ARIEL3(NCT01968213),在所有三项主要疗效分析中,与安慰剂相比rucaparib明显改善了患者的PFS:BRCA突变型(16.6个月Vs 5.4个月);同源重组缺陷(homologous recombination deficient, HRD)阳性(13.6个月Vs 5.4个月);总体意向治疗人群(10.8个月Vs 5.4个月)[10]。

2017年10月10日,基于ARIEL3临床试验结果,FDA批准了对rucaparib在卵巢癌中的维持治疗[11]。Rucaparib除了在BRCA基因突变的铂敏感复发患者中能明显改善PFS,在野生型BRCA基因杂合性缺失(loss of heterozygosity,LOH)比率高的患者中也有很好的疗效,目前该药暂未于我国上市。
(3)Niraparib
在PARP抑制剂系列中,niraparib(Zejula)是该类别中第三种获得FDA批准用于癌症化疗的药物。olaparib和rucaparib已经被批准用于简单治疗化疗有效的患者,而niraparib已成为第一种获得全球批准用于复发性妇科肿瘤患者维持治疗的药物。

在一项多中心随机对照双盲临床2期试验中(ENGOT-OV16 / NOVA试验),niraparib组患者的PFS是安慰剂组患者的近4倍[12]。在没有BRCA基因突变但有同源重组缺陷(HRD)的患者中,niraparib组的PFS比安慰剂对照组也延长了近4倍(12.9 vs 3.8个月);在没有BRCA突变的患者中,niraparib组的PFS是9.3个月,而安慰剂对照组是3.9个月,延长了5.4个月。并且该药物不受进食时间和其他药物的影响,每日服用一次,且服用剂量低于olaparib和rucaparib。有研究表明,niraparib可用于对于既往治疗有效果的任何种类的卵巢癌,并且不论HRD状态如何,该药都可使用。目前该药暂未于我国上市。
伴随诊断测试
伴随诊断测试[13]对于鉴定最佳PARP抑制剂治疗的癌症患者至关重要。 Myriad公司的BRACAnalysisCDxTM是唯一经FDA批准的测定olaparib治疗合格性的测试。

Rucaparib的伴随诊断测试(FoundationFocusTMCDxBRC检测种系和体细胞BRCA1/2 mut的测试)是FDA批准的第一个二代基因测序(NGS),用于评估患者是否可使用rucaparib治疗。Niraparib的伴随诊断测试是myChoice HRDTM测试(Myriad Genetics公司)。BRACAnalysisCDxTM,正如其名称所解释的,该诊断测试仅评估样品的BRCA。由同一公司开发的myChoiceHRDTM,评估超出BRCA部分的杂合性缺失,并且被认为是BRACAnalysisCDxTM的增强版。这是一项基于二代基因测序的分析,用于评估BRCA1/2序列和由LOH形成的基因组瘢痕(HRD评分),端粒等位基因平衡和大规模转换。
3 表皮生长因子(epithelial growth factor, EGF)受体阻断剂
表皮生长因子受体(EGFR)是上皮细胞的基本信号通路,EGFR抑制剂可阻碍EGFR与配体结合,抑制受体酪氨酸激酶磷酸化,并且抑制肿瘤细胞生长。有分为EGFR的单克隆抗体和EGFR酪氨酸激酶抑制剂,常见药物有西妥昔单抗(Cetuximab,爱必妥,默克尔)、曲妥珠单抗(Trastuzumab,赫赛汀,罗氏)、吉非替尼(Gefitinib,易瑞沙,阿斯利康)和埃罗替尼(Erlotinib)等。上述药物在中国上市的,其适应症均不涵盖妇科肿瘤。
总结:
虽然抗癌靶向药物很多,但因为各种原因导致中国病人能用的妇科肿瘤药物却是有限的,处于一个尴尬境地。好消息是,李克强总理近日就电影《我不是药神》引发舆论热议作出批示,要求有关部门加快落实抗癌药物降价保供等相关措施。“抗癌药是救命药,不能税降了价不降。”总理说,“必须多措并举打通中间环节,督促推动抗癌药加快降价,让群众有切实获得感。”总理明确要求这项工作要进一步“提速”:“对癌症病人来说,时间就是生命!”
参考文献:
[1] Eskander RN, Tewari KS. Development of bevacizumab in advanced cervical cancer: Pharmacodynamic modeling, survival impact and toxicology.?Future Oncol.?2015;11:909–922. https://doi.org/10.2217/fon.14.276
[2] KS Tewari MS, Penson R, Huang H, et al. Final overall survival analysis of the Phase III randomized trial of chemotherapy with and without bevacizumab for advanced cervical cancer: a NRG Oncology – Gynecologic Oncology Group Study. Presented at: 2014 Annual Meeting of the European Society of Medical Oncology; Madrid, Spain. 28 September 2014; (Late Breaking Abstract #26). Final overall survival analysis of GOG 240 showing a sustained benefit in the bevacizumab containing arms.
[3] Tewari KS, Sill MW, Long HJ, 3rd, et al. Improved survival with bevacizumab in advanced cervical cancer.?N. Engl. J. Med. 2014;370:734–743.?First clinical trial to results in the approval of a targeted agent, bevacizumab, in the treatment of a gynecologic cancer. Resulted in US FDA approval of bevacizumab in this disease setting.
[4] Ignace V, David S, Ronald B, et al. A phase 2 randomised discontiuation trial of cabozantinib in patients with ovarian carcinoma, European journal of cancer (Oxford, England?: 1990). 2018 Mar
[5] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin2016662115-132. ?
[6] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012.?CA Cancer J Clin.?2012;62(1):10–29.
[7] Fong PC,Yap TA,Boss DS,et al. Poly (ADP) -ribose polymerase inhibition: frequent durable responses in BRCA carrier ovarian cancer correlating with platinum -free interval [J]. J Clin Oncol 201028152512-2519. ?
[8] Yonemori K,Tamura K,Kodaira M,et al. Safety and tolerability of the olaparib tablet formulation in Japanese patients with advanced solid tumours[J]. Cancer Chemother Pharmacol2016783525- 531. ?
[9] Mariappan L, Jiang XY, Jackson J, Drew Y. Emerging treatment options for ovarian cancer: focus on rucaparib.?International Journal of Women’s Health. 2017;9:913-924. doi:10.2147/IJWH.S151194.
[10]Coleman RL, Oza AM, Lorusso D, Aghajanian C, Oaknin A, Dean A, et al. Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;390(10106):1949–61.
[11]Broderick JM: FDA Approval Sought for Maintenance Rucaparib in Ovarian Cancer. Available at: http://www.onclive.com/web-exclusives/ fda-approval-sought-for-maintenance-rucaparib-in-ovarian-cancer. Accessed 20 Oct 2017.
[12] Mirza MR, Monk BJ, Herrstedt J, Oza AM, Mahner S, Redondo A, et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. N Engl J Med. 2016;375(22):2154–64.
[13] Sisay M, Edessa D. PARP inhibitors as potential therapeutic agents for various cancers: focus on niraparib and its first global approval for maintenance therapy of gynecologic cancers.?Gynecologic Oncology Research and Practice. 2017;4:18. doi:10.1186/s40661-017-0055-8.
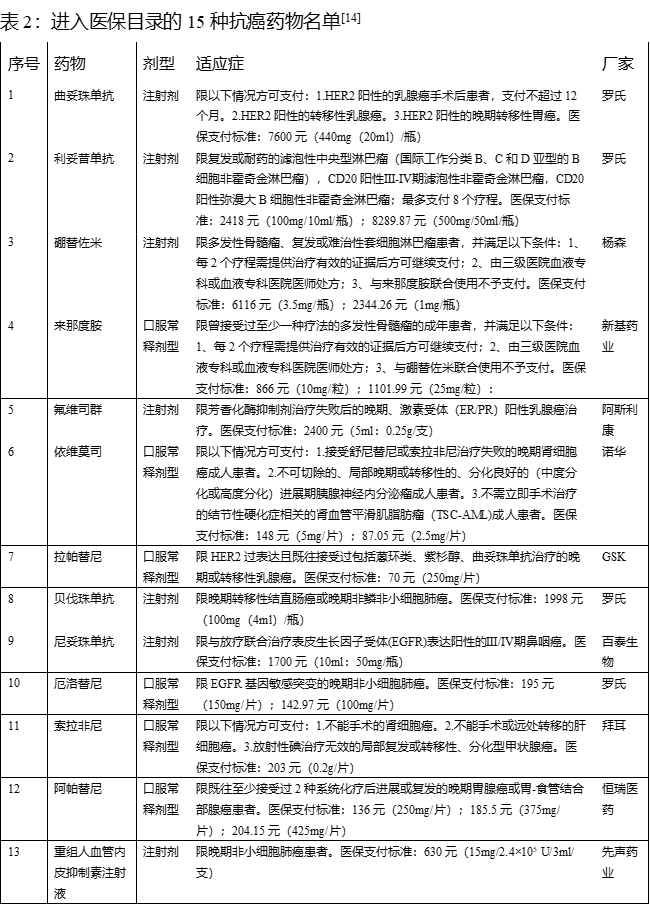
[14] https://www.zgylbx.com/index.php?m=content&c=index&a=lists&catid=105
+ 关注

hi,
提交评论




+ 关注
[Ta的贡献]
查看更多 >
投资人交流群
限量名额,微信扫码申请